Ravitsemus
Tiede autofagosytoosi ja muodikkaan pätkäpaaston takana
Pätkäpaasto oli vuoden 2020 suosituin dieetti. Noudattivatpa he sitten 16:8-, 5:2- tai vain arkipaastoa, 17 miljoonaa amerikkalaista tarttui tähän muotidieettiin. Kuten kaikkien muidenkin trendidieettien kohdalla, ihmiset ja julkkikset tukkivat Instagramin menestystarinoillaan, ja kaikki jäivät nopeasti koukkuun pätkäpaastoon.
Mutta oletko koskaan miettinyt, mitä kehossasi tapahtuu, kun paastoat?
Tunnetko autofagosytoosin ja paaston taustalla olevan tieteen?
Tänään olen täällä murtamassa autofagosytoosiin (tai lyhyemmin autofagian) ja pätkäpaastoon liittyviä myyttejä, jotta sinulla olisi 100%:sen todellinen käsitys siitä, mitä kehossasi tapahtuu paastotessasi.
Table of Contents
Mikä on autofagia / autofagostyoosi?
Englanninkielinen termi ”autophagy” tulee sanoista ”auto” ja ”phagy”. ”Auto” tarkoittaa itseä, ”phagy” tarkoittaa syömistä. Autofagia tarkoittaa siis kirjaimellisesti itsesyömistä. Se on itsekannibalismin muoto, mutta EI huonolla tavalla. Se on kehon luonnollinen tapa puhdistaa kuolleita, vaurioituneita ja vanhoja soluja. Näin keho voi tuottaa ja uudistaa uusia, terveitä soluja.
Olemme aina jumissa mässäilytilassa
Noin kahden miljoonan evoluutiovuotemme aikana, kun ihmiset haartautuivat suurista apinoista, oli aikoja, jolloin ruokaa oli runsaasti saatavilla ympäristössämme. Oli myös aikoja, jolloin ruokaa oli tarjolla niukasti. Kuitenkin nykyään, ainakin useimmille kehittyneessä maailmassa, on kaloreita saatavilla runsaasti koko ajan. Joten normaalissa elämässä emme enää käy läpi juhla-ateria- ja nälänhätäsykliä, kuten joskus muinoin. Sen sijaan olemme aina jumissa ”mässäilytilassa” ja syömme kuin joka päivä olisi juhla-ateria.
Ongelmana tässä on se, että kehityimme juhlimaan ja nälkiintymään tasaisin väliajoin, joten kehomme toimivat parhaiten, kun ne altistuvat molemmille.
- Kun saamme tarpeeksi ruokaa, kehon solut voivat kasvaa ja lisääntyä. Mutta kun ruokaa ei ole tarpeeksi saatavilla, keho voi ikään kuin ”kääntää aineenvaihduntakytkintä”(1), joka sen sijaan keskittyy vahvistamaan solujemme reaktiota stressiin.
- Solut tekevät tämän hajottamalla vanhoja ja viallisia solukomponentteja, uudistamalla ja regeneroimalla niitä ja lisäämällä esimerkiksi antioksidanttien tuotantoa.
- Hajonneita osia voidaan sitten käyttää uusien solukomponenttien tai energian tuotantoon.
Jotta pysyisimme terveinä, ihannetapauksessa tarvitsemme hyvän tasapainon näiden kahden välillä.
Pätkäpaaston edut ja haitat
EDUT: Liika herkuttelu, vaurioituneet proteiinit ja muiden solun osien kerrostuminen voi johtaa siihen, etteivät solut tee työtään kunnolla. Koska solut muodostavat kehomme täydellisesti, mukaan lukien elimet, lopulta kaikki muu kehossamme alkaa mennä myös pieleen.
HAITAT: Liian suuri nälkiintyminen voi kuitenkin aiheuttaa myös ongelmia, koska käytämme liikaa aikaa solujen hajottamiseen korjausprosesseja varten, emmekä energiantuotantoon.
Tarvitsemme todellakin tasapainon näiden kahden toiminnon välillä. Ajoittainen paasto antaa meille mahdollisuuden tehdä tämän, koska voimme jäljitellä alkukantaisen nälänhädän jaksoja ja yhdistää tämän helposti ”juhla-aterioihin”.
MTOR vs. Autofagosytoosi
Mässäilyn ja nälkiintymisen välinen tasapaino näkyy kahdessa vastakkaisessa soluprosessissa, jotka molemmat käyvät kehossamme samanaikaisesti; ne ovat mTOR ja autofagosytoosi.
mTOR – Entsyymi, Pääsiäissaari ja mistä kehonrakentajat unelmoivat!
Ensimmäinen, mTOR, on kasvuprosessi. mTOR tarkoittaa ”rapamysiinin mekanistista kohdetta” (mechanistic target of rapamycin).
Se on hauska nimi, mutta sen takana on hyvä syy. Se sai nimensä maaperän bakteerin mukaan, joka löydettiin ensimmäisen kerran tutkimusmatkalla Pääsiäissaarelle 1960-luvulla. Pääsiäissaari on saari Tyynenmeren alueella, noin 3200km päässä Chilen rannikolta, ja se on kuuluisa saaren yli 1000 muinaispatsaastaan, jotka ovat myös maailmanperintökohteita. Pääsiäissaari tunnetaan saaren asukkaiden nimellä Rapa Nui, joten bakteereita kutsuttiin rapamysiiniksi Rapa Nuin saaren nimen mukaisesti.
mTOR ei ole maaperän bakteeri. Se on itse asiassa entsyymi, jota tuotetaan kehossamme. Maaperäbakteeri rapamysiini stimuloi mTOR:in aktiivisuutta, joten entsyymi tunnettiin rapamysiinin ”kohteena”. Kun tätä entsyymiä stimuloidaan, solut alkavat kasvaa ja tuottaa proteiineja ja lisääntyä nopeammin. mTOR on tuttu kehonrakentajille ja muille voimaharrastajille, jotka yrittävät stimuloida sitä mahdollisimman paljon.
Autofagosytoosi – Tiede pätkäpaaston takana
mTOR:in päinvastaista prosessia kutsutaan autofagiaksi, kun solut alkavat hajottaa vanhoja ja vaurioituneita osia. Koska nämä kaksi prosessia ovat toistensa vastakohdat, kun mTOR:ia stimuloidaan, autofagosytoosi on vastaavasti matala. Ja kun autofagosytoosia stimuloidaan, mTOR on alhainen.
Kuinka autofagosytoosi tarkalleen toimii?
• Autofagosytoosissa solut muodostavat erityisiä rakenteita, joita kutsutaan fagoforeiksi.
• Fagoforit ovat kalvoja, jotka kasvavat hitaasti muodostaen pallomaisen muodon, joka on peitetty kalvolla.
• Kalvo on valmistettu lipidikaksoiskerroksesta.
• Lipidit ovat rasvapohjaisia molekyylejä, ja lipidikaksoiskerrokset ympäröivät myös kaikki soluissamme olevat organellit ja kaikki solumme, kaikki 20 miljardia niistä!
• Soluorganellit suorittavat soluissamme erilaisia toimintoja, ja ne voidaan kuvata hieman kehomme eri elinten tavoin.

Fagoforien muodostuminen
Kun pallo tai fagofori on muodostumassa, se liikkuu solun ympäri. Se kerää proteiineja ja muita organelleja, joille on annettu erityinen merkki, joka kertoo fagoforille, että ne on valittu hajotettavaksi. Tätä erityistä merkkiainetta kutsutaan ubikitiiniksi. Fagofori liikkuu sitten solun ympäri keräten kaikki ubikitinoidut proteiinit ja organellit.
Fagoforien muodostuminen on valmis
Kalvot muodostuvat sitten täysin proteiinien ja organellien ympärille. Kun näin tapahtuu, rakenteen nimi vaihtuu fagoforista autofagosomiksi. Tämä autofagosomi siirtyy sitten kohti lysosomia ja sulautuu sen kanssa. Lysosomi on organelli, jonka voidaan ajatella olevan kuin solun vatsa, vaikka se ei olekaan totta, koska solu sisältää monia lysosomeja!
Kuitenkin, kuten vatsassakin, lysosomien sisältö on hapan ja sisältää ruuansulatusentsyymejä, jotka hajottavat proteiinit ja organellit. Kun ne on jaoteltu yksittäisiksi aminohapoiksi, niitä voidaan käyttää uudelleen uusien proteiinien, organellien ja jopa uusien solujen rakentamiseen. Tai niitä voidaan käyttää myös maksan energian tuottamiseen prosessissa, joka tunnetaan glukoneogeneesinä. Aminohapot, joita käytetään uusiin soluihin ja proteiineihin, tekevät niin stimuloimalla mTOR-entsyymin, joten sykli täydentää itseään, kun keho vaihtaa autofagian ja mTOR:in välillä.

On olemassa myös tietyntyyppinen autofagia, joka käsittelee mitokondrioita. Tämä tapahtuu mitokondrioiden selektiivisellä hajoamisella mitofagiaksi kutsutun prosessin kautta. Mitokondriot, myös organellit, ovat solujemme moottorit ja tuottavat energiaa. Niitä on kussakin soluissamme paljon, vähintään 2000 kappaletta tai enemmän.
Koska kuitenkin käytämme happea energian tuottamiseen ja happi aiheuttaa oksidatiivista stressiä, mitokondriomme käsittelevät jatkuvasti vapaita radikaaleja. Tämä tarkoittaa, että ne ovat erittäin alttiita vaurioille, joten vaurioituneiden mitokondrioiden hajoaminen ja korjaaminen on kriittinen prosessi mitofagiassa.
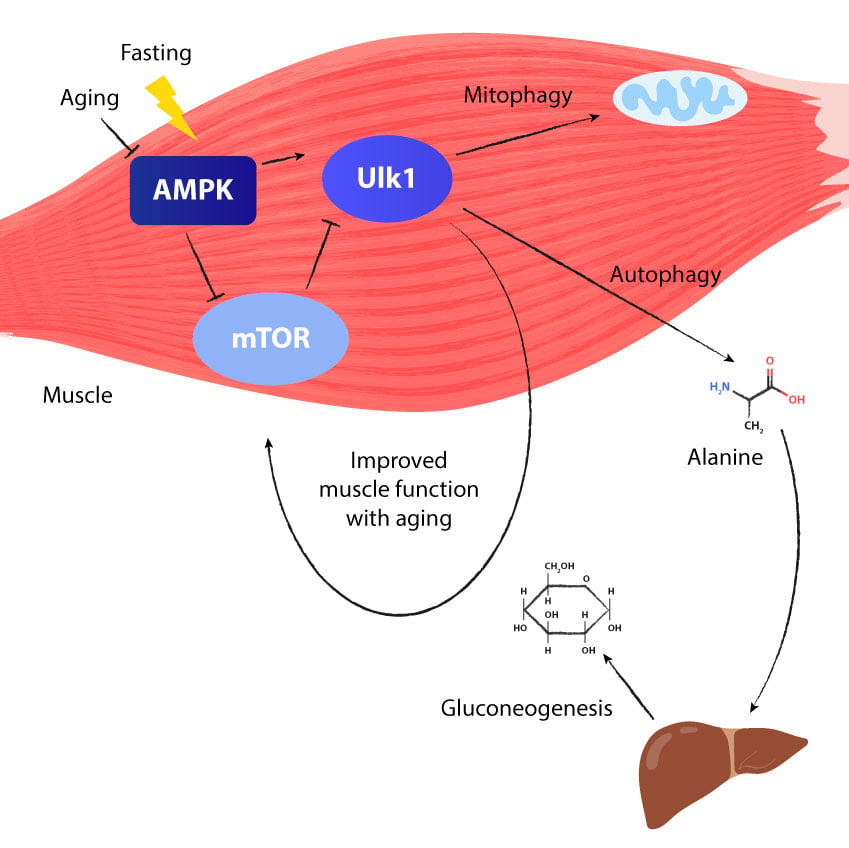
Kuinka paasto stimuloi autofagosytoosia ja mitofagiaa
Kun paastoamme, saamme vähemmän energiaa ruoan kautta. Tämä johtaa vähäiseen energian epätasapainoon, kun energiaa käytetään enemmän kuin tuotetaan. Kehossa oleva erityinen entsyymi seuraa jatkuvasti tätä energiatasapainoa; tätä entsyymiä kutsutaan AMPK:ksi (adenosiinimonofosfaatilla aktivoitu proteiinikinaasi eli adenosine monophosphate-activated protein kinase).
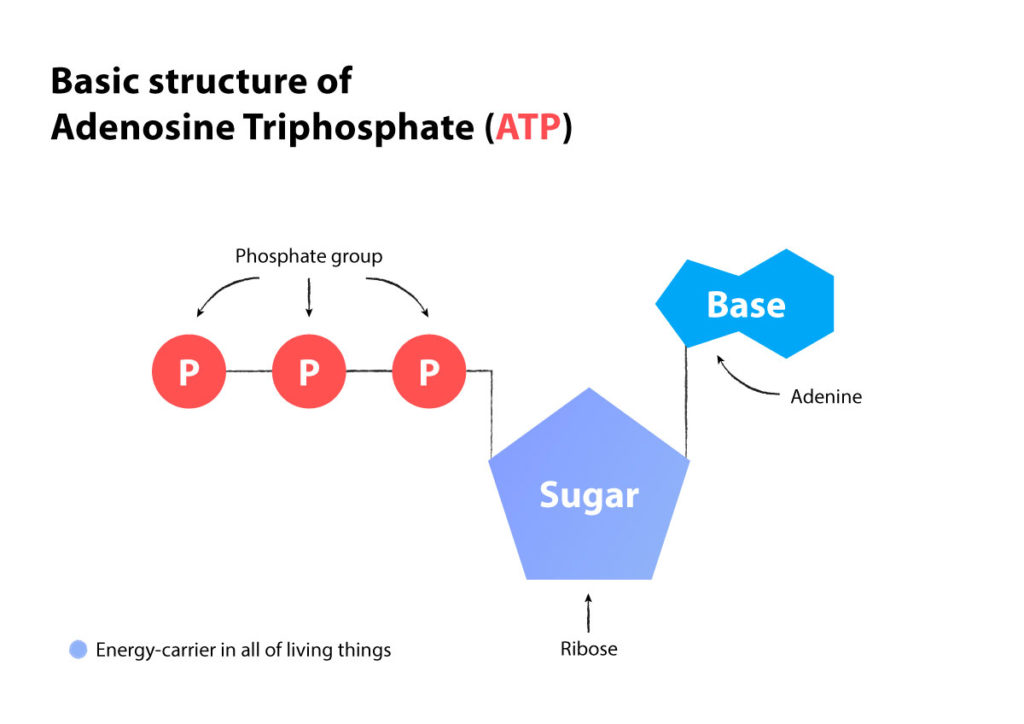
Se tekee tämän aistimalla jotain, jota kutsutaan AMP-ATP-suhteeksi.
ATP vapauttaa energiaa samalla kun se vapauttaa fosfaattimolekyylin ja hajoaa ADP:ksi. Kun energiaa on vähän, kaksi ADP:tä yhdistetään ATP:ksi, jolloin AMP jää jäljelle. (ATP on adenosiinimolekyyli, johon on kiinnittynyt kolme fosfaattia, ADP on adenosiinimolekyyli, johon on kiinnittynyt kaksi fosfaattia, ja AMP on adenosiinimolekyyli, johon on kiinnittynyt yksi fosfaatti).
ATP = adenosiinitrifosfaatti (3 fosfaattia)
ADP = adenosiini-di-fosfaatti (2 fosfaattia)
AMP = adenosiinimonofosfaatti (1 fosfaatti)
Kun kaksi ADP: tä tulee yhteen (kaksi fosfaattia plus kaksi fosfaattia), se tuottaa ATP:tä (kolme fosfaattia) AMP:n kanssa (yksi fosfaatti jäljellä).
Kun AMP:n suhde kasvaa suhteessa ATP:hen, se osoittaa, että energiaa on vähemmän ja AMPK:ta stimuloidaan. Kun AMPK:ta stimuloidaan, se stimuloi toista ULK1-proteiinia, joka johtaa fagoforiksi tulevien membraanien tuotantoon.
NAD + ja Sirtuiinit
Paasto nostaa myös NAD+: n, NADH:n hapettuneen muodon tasoa, joka on aktiivinen B3-vitamiinin muoto (elintärkeä energiantuotannolle).
Sirtuiinit ovat proteiiniperhe, joka stimuloi suoraan autofagosytoosia
Energian tuotanto mitokondrioissa johtaa siihen, että yhä useamamsta NADH:sta tulee NAD+. Tämä NAD+: n ja NADH -suhteen kasvu stimuloi sirtuiinien tuotantoa.
Sirtuiinit ovat proteiiniperhe, joka stimuloi suoraan autofagosytoosia. Niiden tuotantoon liittyy myös pidempi elinikä ja lisääntynyt DNA:n korjaaminen (2).
Sekä AMPK, että sirtuiinit aktivoivat myös muita geenejä, joilla tiedetään olevan monia terveysvaikutuksia, erityisesti esim. FoxO-perhe, TFEB, PGC-1a ja P53.
- FoxO-perheen aktivoituminen liittyy lisääntyneeseen stressinsietokykyyn, pidempään elinikään ja matalempaan kasvainten (eli syöpien) esiintyvyyteen. Tämä johtuu toimintahäiriöisistä soluista, jotka saatetaan tekemään solumurha (apoptoosi) sen sijaan, että ne jatkaisivat kasvua ja mahdollisesti muuttuisivat kasvaimiksi (3).
- TFEB on uusien lysosomien tuotannon päästimulaattori, joten se on suoraan mukana autofagosytoosissa.
- P53 tunnetaan ”genomin vartijana”, koska se estää DNA-mutaatiot (4) ja tukahduttaa kasvaimen muodostumisen (5).
- PGC-1a on ensisijainen geeni, joka osallistuu uusien mitokondrioiden tuotannon stimulointiin. Mitä enemmän mitokondrioita meillä on, sitä vähemmän stressiä olemassa olevat mitokondriomme kokevat tuottaessaan tarvitsemaamme energiaa. Tämä tekee energiantuotannostamme tehokkaampaa, ja mitä tehokkaampaa se on, sitä vähemmän meillä on vapaita radikaaleja.
Ketoosin rooli autofagosytoosissa
Pätkäpaasto johtaa myös rasvakudoksen hajoamiseen, mikä lisää maksaan saapuvien vapaiden rasvahappojen määrää. Tämä puolestaan kasvattaa tuotettujen ketoaineiden määrää (1).
Ketoaineet ovat rasvapohjaisia molekyylejä, jotka voivat tuottaa energiaa
Ketoaineet ovat rasvapohjaisia molekyylejä, jotka voivat tuottaa energiaa erittäin tehokkaasti. Ketoaineiden polttaminen energiaksi tuottaa vähemmän vapaita radikaaleja, ja niiden käyttö vähentää tulehduksia. Ketoaineet stimuloivat myös BDNF:n (aivoperäinen neurotrofinen tekijä eli brain-derived neurotrophic factor) tuotantoa. BDNF on aivojen kasvuhormoni ja stimuloi uusien aivosolujen (neuronien) kasvua. Se edistää myös uusien synapsejen muodostumista, jotka ovat yhteyksiä hermosolujen välillä (1). Mitä enemmän yhteyksiä tai synapseja meillä on, sitä enemmän voimme oppia ja ymmärtää.
Miksi paastodieetit ovat niin suosittuja vuonna 2021?
Eli miten tämä pätkäpaastotiede todella johtaa terveydellisiin hyötyihin?
Painonpudotus
Monet ihmiset päättävät kokeilla paastoa sen painonpudotusvaikutuksen vuoksi. Tutkimukset ovat osoittaneet, että koehenkilöt menettävät keskimäärin 2,5–9,9% ruumiinpainostaan 3–6 kuukauden jaksolla, jonka paastotutkimus toteutettiin (7, 8). Laihtumisen on myös osoitettu olevan rasvaperäistä lihasmassan sijaan.
Paastoaminen voi auttaa säätelemään glukoosi- ja insuliinitasoja
Pätkäpaaston on myös osoitettu vähentävän paaston aikaisia glukoosi- ja insuliinitasoja diabeetikoilla (10), liikalihavilla ihmisillä (7) ja ei-liikalihavilla (11). Lisäksi nuorilla ylipainoisilla naisilla tehdyssä tutkimuksessa havaittiin kokonais- ja LDL-kolesterolin, triglyseridien, sekä verenpaineen lasku. He havaitsivat myös vähenemisen tulehdusta merkkaavassa C-reaktiivisessa proteiinissa ja leptiinihormonissa, joka yleensä nousee korkeammalle liikalihavilla henkilöillä.
Paasto auttaa testosteronin säätelyssä
Tutkijat havaitsivat myös lisääntyneen SHBG:n (sukupuolihormoneja sitova globuliini), joka auttaa vähentämään testosteronin vaikutuksia. Kuitenkin, kun testosteroni kiipeää naisilla liian korkealle, sillä voi olla ei-toivottuja sivuvaikutuksia (12).
Pätkäpaastolla voi olla jopa ikääntymistä hidastavia vaikutuksia
Suurin osa pätkäpaastoa ja ikääntymistä koskevista tutkimuksista suoritetaan eläimillä. Syy tähän on yksinkertainen – näiden tutkimusten tekeminen ihmisillä on hyvin vaikeaa, koska et voi seurata ihmistä koko elämän ajan, ainakaan varmistaen samalla, että he seuraavat pätkäpaastoa.
AMPK:n ja sirtuiinien stimulaatiolla ajoittaisen paaston aikana on kuitenkin voimakas yhteys eläinten eliniän pidentymiseen.
Tutkimukset ovat osoittaneet, että pätkäpaasto pidentää hiirien ja apinoiden elinikää ja riski kehittää ikääntymiseen liittyviä sairauksia on matalempi (13). Eräässä hiiritutkimuksessa havaittiin myös, että paastoavien hiirten lihasmassan väheneminen väheni, joka on yleistä normaalin ikääntymisen aikana (9).
Johtopäätös: Onko autofagosytoosin stimulointi pätkäpaaston ohella todella sen arvoista?
Ajoittaisella paastolla voi olla erittäin myönteisiä terveysvaikutuksia:
- Se voi stimuloida autofagosytoosia.
- Se liitetään pidempään elinikään.
- Se voi stimuloida uusien mitokondrioiden tuotantoa.
- Se voi vähentää tulehdusta ja parantaa sydän- ja verisuoniterveyttä.
- Se auttaa laihtumaan.
- Ja se voi auttaa vähentämään naisten korkeita testosteronitasoja.
Vaikka on olemassa erinomaisia etuja, en ole kuitenkaan maininnut yhtä mahdollista paasto-ongelmaa. Meidän on varmistettava, että varmasti paastoamme, emmekä näännytä itseämme.
Kun paasto tehdään oikein, sen ei pitäisi aiheuttaa huonoja sivuvaikutuksia, kuten huimausta, heikotusta, ärtyneisyyttä tai muita erittäin ikäviä sivuvaikutuksia.
On OK tuntea itsesi hieman nälkäiseksi. Jos kuitenkin tunnet olosi kurjaksi tai tunnet ettet voi odottaa ruoka-aikaa, näännytät itseäsi, joka taas laukaisee kehon nääntymisreaktion.
Näännymme, kun emme tuota tarpeeksi ketoaineita aivojemme polttoaineeksi. Kun aivomme eivät saa tarpeeksi energiaa syötyämme, aivomme havaitsevat hengenvaarallisen ruokapulan. Sitten aivomme tekevät kaikkensa saadakseen meidät lopettamaan asioiden tekemisen ja säästääkseen energiaa, joka saa meidät tuntemaan olomme surkeaksi.
Olen kirjoittanut yksityiskohtaisen oppaan siitä, miten välttää nälkiintyminen pätkädieetillä, joten lue se ennen kuin päätät sopiiko pätkäpaasto sinulle.
Jokaisella, jolla on tarpeeksi oikeaa tietoa ja ymmärrystä pätkädieetistä, tulisi kokeilla sitä ja nauttia sen tarjoamista terveyseduista!
Lähteet
(1) Stephen D. Anton, Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie Lee, Arch G. Mainous, III, Christiaan Leeuwenburgh, and Mark P. Mattson, Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting, Obesity (Silver Spring). 2018 Feb; 26(2): 254–268.
(2) Uribarri J, Woodruff S, Goodman S, Cai W, Chen X, Pyzik R, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet. J Am Diet Assoc. 2010;110: 911–916
(3) Eric L Greer & Anne Brunet, FOXO transcription factors at the interface between longevity and tumor suppression, Oncogene volume 24, pages7410–7425(2005)
(4) Read AP, Strachan T (1999). “Chapter 18: Cancer Genetics”. Human molecular genetics 2. New York: Wiley.
(5) Surget S, Khoury MP, Bourdon JC (December 2013). “Uncovering the role of p53 splice variants in human malignancy: a clinical perspective”. OncoTargets and Therapy. 7: 57–68.
(6) Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). “Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches”. Curr. Pharm. Des. 20 (35): 5619–5633.
(7) Heilbronn LK, Smith SR, Martin CK, Anton SD, Ravussin E. Alternate-day fasting in nonobese subjects: effects on body weight, body composition, and energy metabolism. Am J Clin Nutr [Internet] 2005;81:69–73.
(8) Byrne NMM, Sainsbury A, King NAA, Hills APP, Wood REE. Intermittent energy restriction improves weight loss efficiency in obese men: the MATADOR study. Int J Obes [Internet] 2017:1–10.
(9) Van Norren K, Rusli F, Van Dijk M, Lute C, Nagel J, Dijk FJ, Dwarkasing J, Boekschoten MV, Luiking Y, Witkamp RF, Müller M, Steegenga WT, Behavioural changes are a major contributing factor in the reduction of sarcopenia in caloric-restricted ageing mice.
J Cachexia Sarcopenia Muscle. 2015 Sep; 6(3):253-68.
(10) Deng X, Cheng J, Zhang Y, Li N, Chen L. Effects of caloric restriction on SIRT1 expression and apoptosis of islet beta cells in type 2 diabetic rats. Acta Diabetol. 2010;47(suppl 1):177–85.
(11) M’guil M, Ragala MA, El Guessabi L, Fellat S, Chraibi A, Chabraoui L, et al. Is Ramadan fasting safe in type 2 diabetic patients in view of the lack of significant effect of fasting on clinical and biochemical parameters, blood pressure, and glycemic control ? Clin Exp Hypertens. 2008;30:339–57.
(12) Harvie MN, Pegington M, Mattson MP, Frystyk J, Dillon B, Evans G, et al. The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: A randomized trial in young overweight women. Int J Obes. 2011;35:714–27.
(13) Beneficial effects of intermittent fasting and caloric restriction on the cardiovascular and cerebrovascular systems. Mattson MP, Wan RJ, Nutr Biochem. 2005 Mar; 16(3):129-37.

